Once - Química
SEGUNDO PERÍODO
ACTIVIDAD N° 1
QUÍMICA ORGÁNICA

QUÉ ES LA QUÍMICA ORGÁNICA?
Es la disciplina científica que estudia la estructura, propiedades, síntesis y reactividad de compuestos químicos formados principalmente por carbono e hidrógeno, los cuales pueden contener otros elementos, generalmente en pequeña cantidad como oxígeno, azufre, nitrógeno, halógenos, fósforo, silicio.
El término “orgánico” procede de la relación existente entre estos compuestos y los procesos vitales, sin embargo, existen muchos compuestos estudiados por la química orgánica que no están presentes en los seres vivos, mientras que numerosos compuestos inorgánicos forman parte de procesos vitales básicos, tales como las sales minerales y metales como el hierro que se encuentra presente en la hemoglobina, entre otros.
 |
De esta manera la química orgánica es también denominada química del Carbono, ya que este elemento es el más abundante en la constitución de la materia orgánica, es decir, la que constituye a la materia viva. Veamos en donde y de que manera encontramos el carbono en la naturaleza.
El carbono es excepcional, sus características le permiten combinarse con gran cantidad de átomos, razón por la cual constituye una variedad muy grande de sustancias orgánicas en la naturaleza.
Pero...qué hace al carbono tan especial y qué le da esa capacidad de combinación?.
Esto lo logra gracias a su propiedad de ser tetravalente, es decir, tiene 4 electrones en su capa de valencia (la capa más externa del átomo, que para el caso del carbono es el segundo nivel). En su estado excitado, es decir cuando se dispone a formar enlaces con otros átomos, el carbono tiene sus cuatro electrones disponibles para formar enlaces covalentes con otros átomos e incluso con el mismo carbono. Allí, en el segundo nivel del carbono, se produce una hibridación o combinación de orbitales s y p que le da la propiedad de formar enlaces sencillos, dobles o triples consigo mismo y además formar enlaces con otros átomos.
En todo caso, es claro que el carbono tiene cuatro electrones en su último nivel para compartir con otros átomos y que siempre que tenemos moléculas donde se encuentre el carbono, estos cuatro electrones deben estar ocupados formando enlaces.

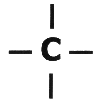
El carbono generalmente estará ocupando sus cuatro electrones con átomos de hidrógeno, sin embargo, no siempre es así, ya que puede formar enlaces carbono-carbono o con otros elementos químicos compatibles con él, como ya se dijo anteriormente, así.
Aquí recordaste conceptos relacionados con la configuración electrónica del carbono, su propiedad tetrahedrica, la hibridación, las clases de hibridación (sp³, sp² y sp) y los enlaces sigma (𝛔) y pi (𝝅) que forma el carbono con otros átomos y consigo mismo. De ser posible revisa el vídeo más de una vez, seguramente cada vez vas a comprender mejor y te vas a familiarizar con la terminología utilizada.
De esta manera el carbono, gracias a su hibridación, puede formar enlaces simples o sencillos con otros átomos, denominados enlaces sigma (𝛔); enlaces dobles, en donde uno de ellos es sigma (𝛔) y el otro es pi (𝝅) o enlaces triples, donde uno es sigma(𝛔) y los otros dos son pi (𝝅), dando lugar a compuestos conocidos como alcanos, enlaces sencillos carbono - carbono; alquenos, enlaces dobles carbono - carbono y alquinos, triple enlace carbono - carbono. Ejemplo: el eteno, cuyos carbonos presentan cada uno 3 enlaces sigma , y un enlace pi (𝝅) porque tiene un enlace doble entre carbono - carbono y presenta hibridación sp².

El siguiente tutorial te ayudará a ampliar los conceptos relacionados con clases de enlaces e hibridación del carbono
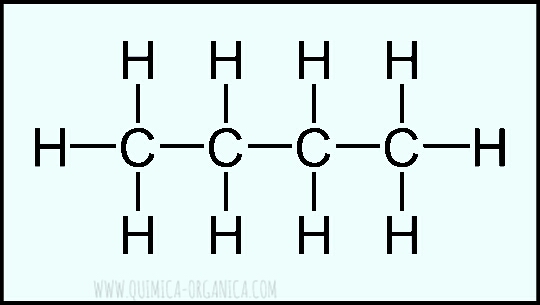 El butano, presenta enlaces simples carbono-carbono y enlaces simples carbono- hidrógeno, entonces podemos decir que esta molécula tiene 13 enlaces sigma (𝛔) y 0 enlaces pi (𝝅), y que cada uno de sus carbonos tiene una hibridación sp³ dado que todos presentan enlaces simples carbono carbono.
El butano, presenta enlaces simples carbono-carbono y enlaces simples carbono- hidrógeno, entonces podemos decir que esta molécula tiene 13 enlaces sigma (𝛔) y 0 enlaces pi (𝝅), y que cada uno de sus carbonos tiene una hibridación sp³ dado que todos presentan enlaces simples carbono carbono.
Recordar: Si entre los carbonos hay enlaces sencillos, la hibridación es sp³, si hay enlaces dobles, la hibridación es sp², si hay enlaces triples, la hibridación es sp.
Bueno...cómo vamos?
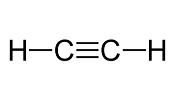
Revisa hasta aquí tu saber, practicando con el siguiente ejercicio. Cuántos enlaces pi y cuantos enlaces sigma encuentras en la siguiente molécula'. Cómo es la hibridación entre sus carbonos?
Observa que el ejercicio esta presentado de dos maneras, una fórmula es desarrollada y la otra es semidesarrollada en donde al lado del carbono escribo de cuántos hidrógenos esta acompañado, escribiendo la cantidad en el lado inferior derecho del hidrógeno. En adelante las fórmulas tendrán esa presentación.
Así se van formando cadenas de carbonos muy largas., algunas son lineales, otras ramificadas y otras son cíclicas o cerradas. Dependiendo de la cantidad de carbonos que se van enlazando los carbonos se van clasificando en: primarios, secundarios, terciarios, cuaternarios. Veamos
La siguiente tabla que he utilizado de un trabajo de la profe Giuliana Churano del colegio Nuestra señora de Guadalupe, en México, nos permite visualizar lo aprendido en el anterior tutorial.
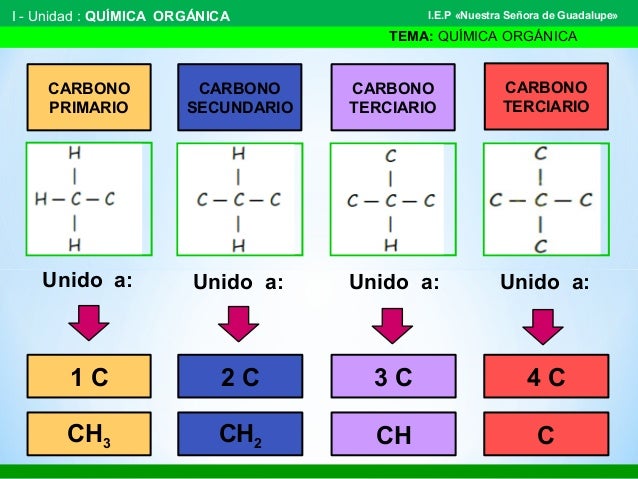
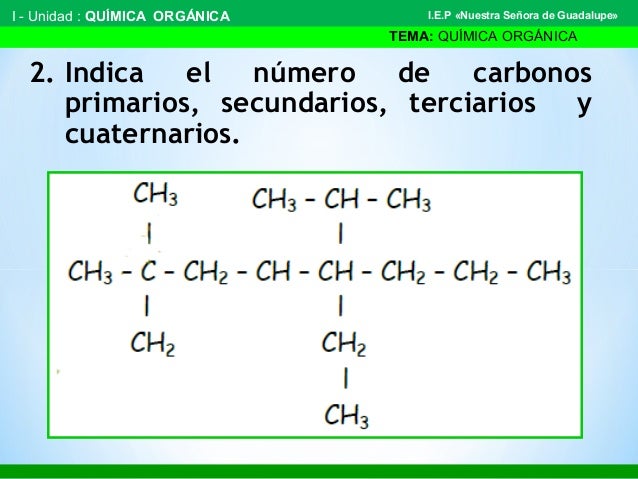
Revisa los siguiente ejemplos donde en el primero te muestran que P es primario, S secundario, T, terciario y Q cuaternario y un segundo ejemplo donde utilizan colores para señalar cada clase de carbono. Son ideas que puedes utilizar al momento de hacer tu trabajo.
Ejercitate clasificando los carbonos del siguiente compuesto. Para realizar el ejercicio debes marcar cada carbono con un número o una letra en la esquina superior izquierda para que puedas identificarlos y saber a que carbono te estas refiriendo cuando los clasifiques.
ACTIVIDAD N° 1

Los compuestos a trabajar son los planteados en el taller que se entrego por whatsapp.
No tener en cuenta estos.

1. Teniendo en cuenta el primer video que observaste, Cuál es la importancia del carbono?
2. Cuáles son las formas alotrópicas del carbono? es decir en qué formas encontramos el carbono en la naturaleza?. Elaborar un mapa conceptual
3. Consultar un gráfico que represente el ciclo del carbono y explicar con tus propias palabras en qué consiste dicho ciclo.
4. Por qué el carbono es el elemento químico que conforma el mayor número de sustancias en la naturaleza?. Argumentar
5. Teniendo en cuenta lo que has estudiado hasta el momento sobre los enlaces pi y sigma, hibridación y clases de carbonos, debes revisar los siguientes compuestos y llenar una tabla en word o a mano y luego la escaneas, como te sea más fácil, con la siguiente información: En la primera columna colocas el compuesto, en la segunda dices los enlaces pi (𝝅), en la tercera los enlaces sigma (𝛔) , en la cuarta columna colocas las hibridaciones carbono - carbono (sp³, sp², sp) y en la quinta clasificas los carbonos del compuesto (primarios, secundarios, terciarios o cuaternarios).
2. Cuáles son las formas alotrópicas del carbono? es decir en qué formas encontramos el carbono en la naturaleza?. Elaborar un mapa conceptual
3. Consultar un gráfico que represente el ciclo del carbono y explicar con tus propias palabras en qué consiste dicho ciclo.
4. Por qué el carbono es el elemento químico que conforma el mayor número de sustancias en la naturaleza?. Argumentar
5. Teniendo en cuenta lo que has estudiado hasta el momento sobre los enlaces pi y sigma, hibridación y clases de carbonos, debes revisar los siguientes compuestos y llenar una tabla en word o a mano y luego la escaneas, como te sea más fácil, con la siguiente información: En la primera columna colocas el compuesto, en la segunda dices los enlaces pi (𝝅), en la tercera los enlaces sigma (𝛔) , en la cuarta columna colocas las hibridaciones carbono - carbono (sp³, sp², sp) y en la quinta clasificas los carbonos del compuesto (primarios, secundarios, terciarios o cuaternarios).
Los compuestos a trabajar son los planteados en el taller que se entrego por whatsapp.
No tener en cuenta estos.
ACTIVIDAD N° 2
LOS HIDROCARBUROS

La mayoría de los combustibles son derivados de los hidrocarburos
Qué son los hidrocarburos?
Son un grupo de compuestos orgánicos que contienen principalmente carbono e hidrógeno. Son los compuestos orgánicos más simples y pueden ser considerados como las principales sustancias de las que se derivan todos los demás compuestos orgánicos.
Pueden encontrarse de forma líquida (petróleo), líquida por condensación (condensados y líquidos del gas natural), gaseoso (gas natural) y sólido (en forma de hielo como son los hidratos de metano).
Los hidrocarburos se pueden clasificar en dos grupos alifáticos y aromáticos. Los alifáticos pueden ser de cadena abierta o de cadena cerrada que también se llaman cíclicos. Tanto los de cadena abierta como los de cadena cerrada pueden ser saturados e insaturados, según los tipos de enlace que unen entre sí los átomos de carbono.. En los de cadena abierta encontramos los saturados como los alcanos e insaturados como los alquenos y alquinos. En los de cadena cerrada encontramos los saturados como los ciclo alcanos y los insaturados como los cicloalquenos y clcloalquinos. Como lo muestra el siguiente esquema para mayor claridad

El anterior mapa conceptual resume la clasificación de los hidrocarburos. Es importante que tomes nota en tu cuaderno.
Los términos saturado e insaturado se refieren a: SATURADOS, se llama así a los alcanos que tienen todos los electrones de los carbonos ocupados haciendo enlaces con hidrógenos y los INSATURADOS, son los alquenos y alquinos, porque los electrones de algunos carbonos en sus moléculas no están ocupados solo con hidrógenos sino que pueden tener dos o tres electrones ocupados haciendo dobles o triples enlaces entre los mismos carbonos.
Dependiendo de la manera como se enlazan los carbonos, las cadenas carbonadas pueden ser: lineales, ramificadas, sustituidas, cíclicas y aromáticos. Complementar el mapa conceptual anterior con los ejemplos que se presentan en el siguiente vídeo.
Ya revisamos qué son y cómo se clasifican los carbohidratos. Ahora iniciamos un recorrido para reconocer cada uno de los grupos de sustancias que los integran y la manera como podemos leerlos, es decir, su nomenclatura según la IUPAC (International Union of Pure and Applied Chemistry). Para complementar un poco mas lo estudiado hasta el momento los remito al siguiente link
En el primer tema, cuando estudiábamos como los carbonos se organizan para formar cadenas y diversos compuestos, hablamos de los alcanos, los alquenos y los alquinos.
Recordemos
Los alcanos tienen enlaces sencillos C - C - C
Los alquenos tienen enlaces dobles C - C = C
NOMENCLATURA
1. Para nombrar los hidrocarburos debemos tener en cuenta en primer lugar lo siguiente:
Para nombrar a los alcanos, se tiene en cuenta la terminación ANO.
Para nombrar a los alquenos, se tiene en cuenta la terminación ENO.
Para nombrar a los alquinos, se tiene en cuenta la terminación INO.
Para nombrar a los alquenos, se tiene en cuenta la terminación ENO.
Para nombrar a los alquinos, se tiene en cuenta la terminación INO.
2. Las cadenas carbonadas se forman por la unión de varios carbonos y según el número de carbonos que se unen en una cadena, se utiliza un prefijo, como lo muestra la siguiente tabla.

La tabla anterior muestra solo hasta doce carbonos, sin embargo, las cadenas pueden ser mucho más largas y de acuerdo con ello se usan los prefijos correspondientes
Atendiendo a la información anterior, las cadenas carbonadas se nombran, por ejemplo así:
- Un alcano de 1 carbono se llama METANO, no existen alquenos ni alquinos de un carbono.
- Un alcano de 2 carbonos se llama ETANO, el alqueno de dos carbonos se llama ETENO, El alquino de dos carbonos se llama ETINO.
- El alcano de cinco carbonos es un PENTANO, el alqueno de cinco carbonos es un PENTENO, el alquino de cinco carbonos es el PENTINO y así sucesivamente.
Los prefijos de la tabla de arriba del vídeo debemos aprenderlos de memoria para facilitar el trabajo de nomenclatura.
Por ahora trabajaremos con los ALCANOS.
A continuación los dejo con una tabla que presenta ejemplos de las fórmulas semidesarrolladas de algunos alcanos de cadena lineal y la manera de nombrarlos usando los prefijos según el número de carbonos.

Estos compuestos que están en la tabla en algún momento pueden convertirse en radicales...Qué es un radical?. Es una molécula como las que muestra la tabla que pueden perder un hidrógeno para adherirse a otra cadena más larga, y así formar las ramificaciones de las cadenas ramificadas, entonces cambia su terminación ANO por IL.
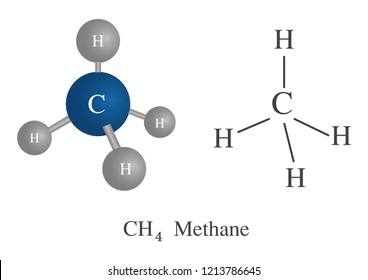
Por ejemplo: el metano que es un carbono con 4 hidrógenos, puede perder uno de sus hidrógenos para adherirse a otra cadena más larga y entonces llamarse METIL

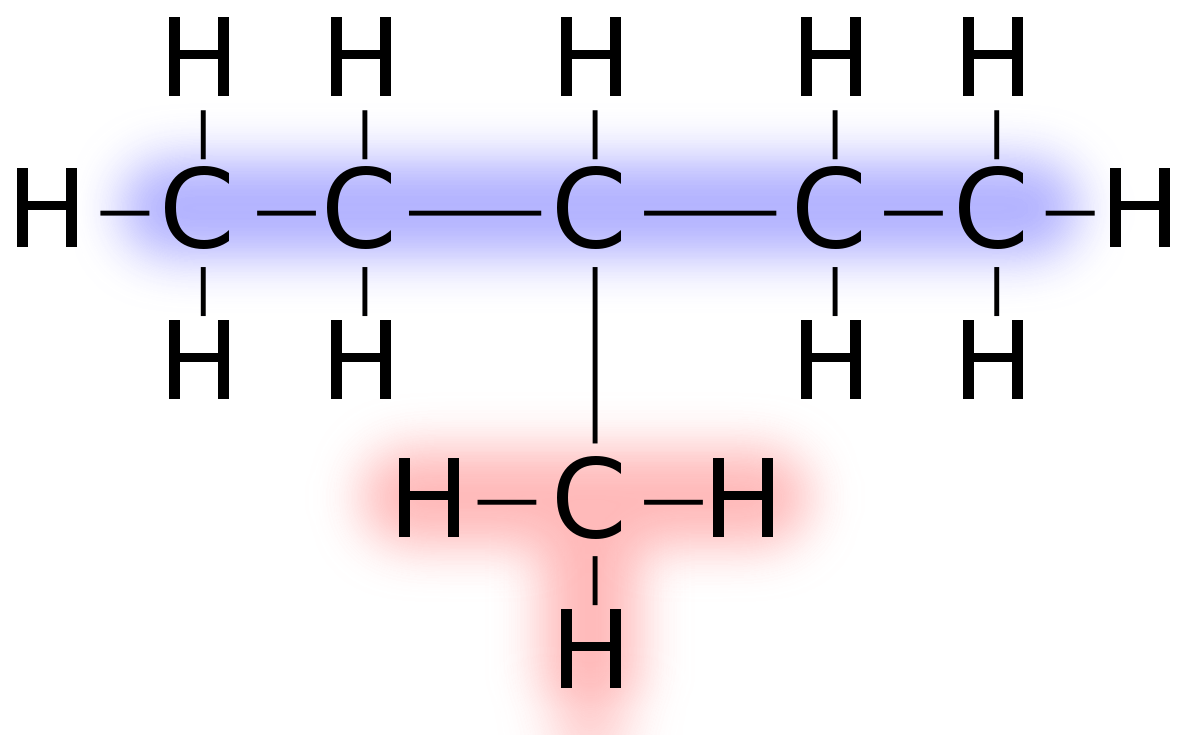
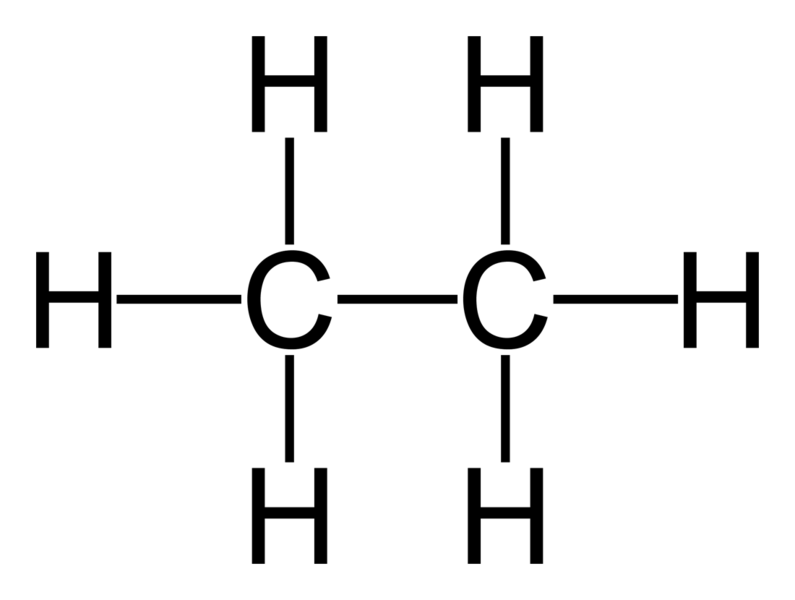
La primera gráfica muestra claramente la molécula de metano (el carbono con sus 4 hidrógenos), seguidamente la segunda gráfica muestra una cadena de 5 carbonos, cada carbono con sus hidrógenos (en azul) y un metil (en rojo). Qué es el metil?, un metano que perdió un hidrógeno para poder unirse a la cadena de cinco carbonos. Tal como se dijo antes.
De igual manera sucede con el etano, que también puede perder un H para adherirse a una cadena más larga y entonces se llamará ETIL, si el radical es de tres carbonos se llama PROPIL, si es de cuatro carbonos se llama BUTIL y así sucesivamente. A estos se les conoce como SUSTITUYENTES ALQUILO o radicales alquilo. También podemos encontrar otros radicales como los siguientes:
Reglas para nombrar alcanos ramificados:
1. Se identifica la cadena más larga de átomos de carbono en la molécula. Está le da el nombre principal al alcano
2. Se enumeran los carbonos, colocando el número en la parte superior izquierda del carbono. Se empieza a enumerar por el extremo que tenga más próximos los radicales.
3. se identifican los radicales que quedan por fuera de la cadena principal.
4. Para dar nombre al compuesto, se escribe en primer lugar el nombre de los radicales o grupos sustituyentes en orden alfabético . A estos nombres se les antepone un número que indica su posición con relaación a la cadena principal y se separa del nombre por un guión.
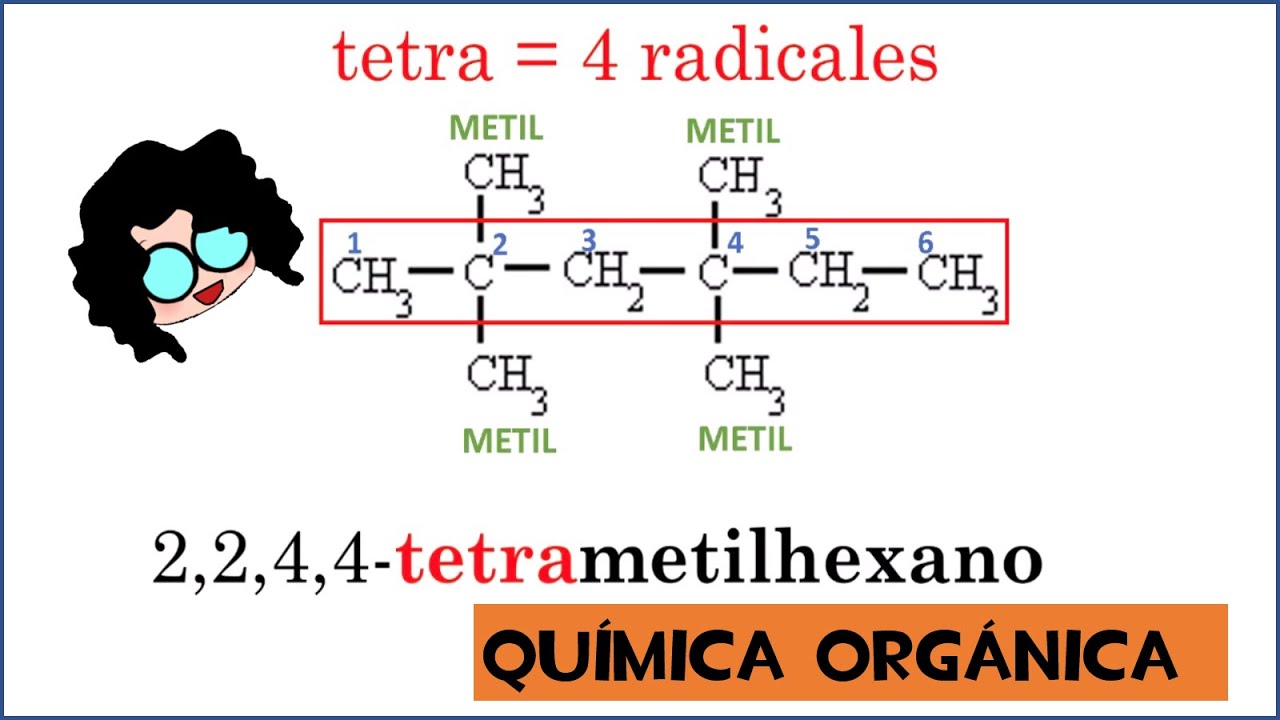
5. Cuando se tienen varias ramificaciones idénticas, se indica el número de veces que se repite colocando el prefijo numérico: di, tri, tetra. etc.,antes del nombre del grupo sustituyente.
Ejemplos:
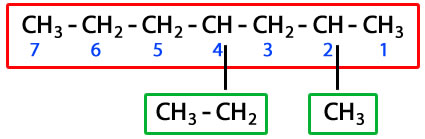
ETIL METIL
4 - Etil - 2 - Metilheptano
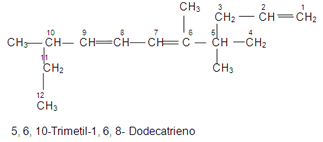
Seleccionamos la cadena más larga, enumeramos los carbonos preferiblemente en el extremo superior izquierdo de los carbonos, en este caso empezando por el extremo derecho porque por allí están más cerca los radicales, luego señalamos los radicales y los nombramos en orden alfabético, colocando primero el número del carbono de la cadena principal donde se encuentra el radical y finalmente colocamos el nombre de la cadena principal teniendo en cuenta el número de carbonos que la componen, en este ejemplo son 7 C, por ello se llama HEPTANO

Esta es una forma muy didáctica para diferenciar todos los elementos a nombrar.
Se procede igual que el ejemplo anterior. en este caso la cadena más larga o cadena principal tiene 6 carbonos, tiene dos metiles y un etil. Se nombran por orden alfabético, por ello primero esta el 4- etil y como en el carbono 2 hay dos grupos metil por ello se escribe dos veces el número dos y se antepone el DI para designar que en la cadena hay dos metiles, 2,2-dimetilhexano
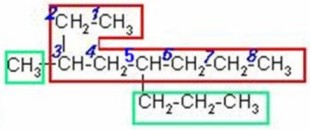
3 - metil - 5 - propiloctano
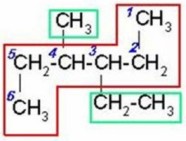
3 - etil - 4 - metilhexano
ACTIVIDAD N° 2
Según se planteó en el taller que se entrego por whatsapp.
ACTIVIDAD N° 3
Se refiere al desarrollo de habilidad en la resolución de preguntas tipo SABER relacionadas con las temáticas estudiadas durante las semanas anteriores.






Comentarios
Publicar un comentario